I polifenoli dell'olio d'oliva proteggono il nostro corpo dallo stress ossidativo, ecco perchè

Dall’attività di scavenging all’induzione di geni Nrf2-dipendenti. Ecco perchè chiamarli semplici antiossidanti è riduttivo. Il composti fenolici dell'olio extra vergine di oliva, attraverso sistemi complessi qui illustrati, possono stimolare una risposta genica attraverso un effetto “ormetico positivo”
 L’organismo umano costantemente genera, per il suo metabolismo aerobio, specie reattive dell’ossigeno e dell’azoto (ROS=Reactive Oxigen Species, RNS=Reactive Nitrogen Species) ed altre molecole radicali, in modo controllato, inattivandoli con sistemi tali da mantenere l’ambiente intracellulare in un equilibrio, tra radicali ossidanti dannosi, e molecole antiossidanti (endogene ed esogene) protettive. L’autoregolazione dell’equilibrio ossido-riduttivo dell’organismo è definita “omeostasi-redox cellulare”.
L’organismo umano costantemente genera, per il suo metabolismo aerobio, specie reattive dell’ossigeno e dell’azoto (ROS=Reactive Oxigen Species, RNS=Reactive Nitrogen Species) ed altre molecole radicali, in modo controllato, inattivandoli con sistemi tali da mantenere l’ambiente intracellulare in un equilibrio, tra radicali ossidanti dannosi, e molecole antiossidanti (endogene ed esogene) protettive. L’autoregolazione dell’equilibrio ossido-riduttivo dell’organismo è definita “omeostasi-redox cellulare”.
Nei processi di fosforilazione ossidativa mitocondriale, il 4-5% dell’ossigeno della respirazione cellulare, non è ridotto a H2O, e forma prodotti intermedi altamente reattivi, cioè molecole con elettroni spaiati. Condizioni di “stress ossidativo”, secondario a un’aumentata produzione di ROS/RNS e/o a una ridotta efficienza dei sistemi fisiologici di difesa antiossidante, sono generati da radiazioni ionizzanti (UV, X, gamma), farmaci e xenobiotici (es. chemioterapici quali le antracicline), infiammazioni / infezioni, metalli pesanti, fumo di sigaretta, inquinamento, esercizio fisico inadeguato e sono causa di malattie degenerative, cardiovascolari, senescenza cellulare, carcinogenesi, aterosclerosi, cataratta, Parkinson/Alzheimer, malattie polmonari e vascolari, diabete ed invecchiamento.
I composti fenolici (PC) dell’olio vergine di oliva (voo) hanno un’attività antiossidante, sia in vivo sia in vitro in particolare modo il tocoferolo, l’oleuropeina aglicone ed il derivato idrossitirosolo (TyOH).
Tale attività è legata alla struttura molecolare dove l’anello fenolico può cedere un atomo di idrogeno (del gruppo –OH) ai radicali liberi, interrompendo la catena ossidativa (chain-breaking); l’anello, diventa, a sua volta, un radicale più stabile, resistente al nuovo assetto elettronico per l’elettrone spaiato che apparteneva all’idrogeno, delocalizzandolo negli orbitali di legame C6 dell’anello stesso. Nel TyOH, il cui anello fenolico ha due gruppi idrossilici, la presenza del secondo gruppo indebolisce l’energia di dissociazione del legame –OH del primo gruppo quindi determina una maggior facilità a donare atomi d’idrogeno e maggior potere antiossidante, anche rispetto tirosolo e derivati.
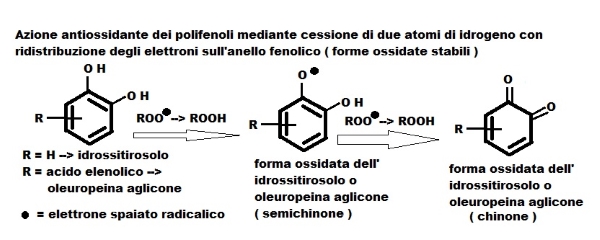
L’azione scavenging (spazzino dei radicali liberi) dei PC trasforma i radicali liberi in composti non radicalici, privi di reattività e quindi di tossicità per le strutture cellulari come ossidabilità delle: lipoproteine di membrana, DNA (legata all’oncogenesi), lipoproteine plasmatiche LDL (legata all’aterosclerosi), neuroni (legata alle m. Alzheimer e Parkinson), strutture come causa di diabete e di malattie croniche degenerative...
I PC, dopo ingestione, resistono all’azione dei succhi gastrici, sono velocemente assorbiti a livello intestinale e attraverso il circolo enteroepatico giungono al fegato dove vengono coniugati, in un processo di esterificazione (enzimatico-specifico) dei due gruppi fenolici (-OH), in forma glucuronata e/o solfatata. La coniugazione epatica serve a rendere i PC, xenobiotici per l’organismo, maggiormente solubili ed eliminabili per via renale. In forma coniugata li ritroviamo nel plasma ad una concentrazione bassissima per poi, entro breve, essere eliminati dall’apparato urinario. La concentrazione plasmatica dei coniugati è molto inferiore ad altri antiossidanti (acido urico, bilirubina, vitamina C ed E…) inoltre è minima la quantità che può essere trasportata all’interno delle cellule, anche se nel citoplasma è presente un enzima che può de-glucuronare i PC e rendere, di nuovo, attivi i loro gruppi fenolici.
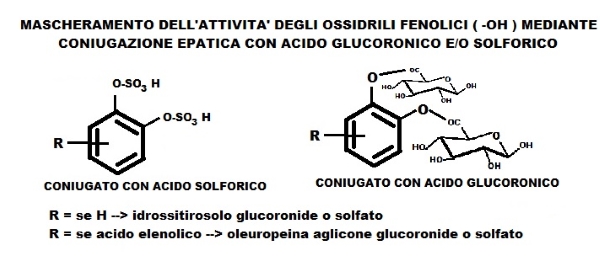
Ci domandiamo come i PC possano avere un’azione antiossidante visto che la concentrazione è così bassa (da micromoli a nanomoli/ g tessuto) e per di più se il sito attivo fenolico è bloccato dalla coniugazione? Come possono, queste concentrazioni infinitesime, influenzare il sistema redox cellulare endogeno di tipo diretto?
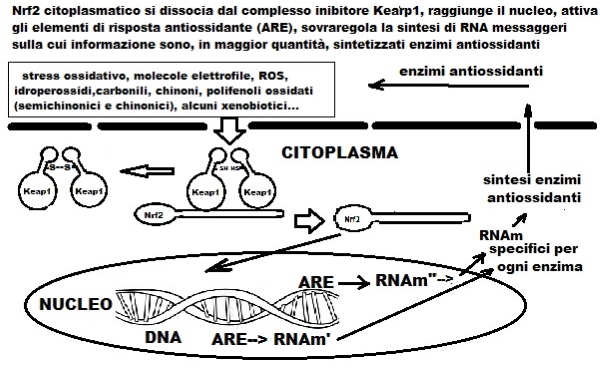
 Le attuali conoscenze del DNA umano e gli studi di omica (nutrigenomica, transcrittomica, epigenomica, proteomica, metabolomica) hanno permesso di capire che gli alimenti possono modificare il nostro DNA e l’espressione di alcuni geni. Nel caso dei PC del voo possiamo avere due vie di attività secondo la concentrazione, via diretta, se questa è elevata ed è di tipo antiossidante scavenging dei radicali mentre, se è bassa, come nel distretto citoplasmatico e plasmatico, via indiretta. Questa tipo di risposta, dipendente dalla dose, viene definita di tipo ormetica e nel caso dei PC, effetto “ormetico positivo”. Le molecole di PC che hanno ceduto il loro atomo d’idrogeno, per impedire che altre strutture fondamentali fossero danneggiate dai radicali liberi, diventano PC-ossidati (chinonici o semichinonici) capaci di indurre uno stress ossidativo transitorio e debbono essere smaltiti. Conseguentemente possono innescare un segnale di sovraregolazione degli enzimi endogeni antiossidanti che possano portare la cellula a un livello superiore di protezione agli effetti dannosi dello stress ossidativo. I Pc-ossidati, entrati nella cellula, si legano al complesso Keap1-SH--Nrf2--Keap1-SH. Questo legame porta all’ossidazione dei gruppi tiolici (-SH) formando Keap1-SS—SS-Keap1, si libera il fattore di trascrizione Nrf2 che migra nel nucleo, si lega alla sequenza del DNA di 16 basi (5’-T-A/C-A-nn-ATGA-C/T-nnn-GCA-3’ dove n= qualsiasi base) denominata ARE (Antioxidant Response Element) attivando i geni dai quali vengono trascritti RNA-messaggeri e quindi sintetizzati dalla cellula una serie di enzimi antiossidanti e detossificanti di fase II della via ossidoriduttasica in risposta a stimoli nocivi. La risposta è l’aumento dell’attività di enzimi come GPX plasmatica (glutatione perossidasi- degrada perossidi), CAT eritrocitaria (catalasi- degrada perossidi) e GSH plasmatici (glutatione ridotto- forte antiossidante che può ossidarsi a G-S-S-G), e altri enzimi antiossidanti. Non dobbiamo dimenticare che il fattore nucleare Nrf2 è un punto chiave, oltre al mantenimento dell’omeostasi redox cellulare, di azioni detossificanti (metabolismo dei farmaci), metabolismo dell’emoglobina dei globuli rossi, metabolismo dei lipidi e lipogenesi, gluconeogenesi, autofagia e apoptosi (morte cellulare programmata, attività che perdono le cellule tumorali). Gli enzimi antiossidanti endogeni, Nrf2- dipendenti, proteggono anche il DNA dall’attacco di radicali di sostanze chimiche genotossiche, responsabili dell’attivazione di oncogeni o di danni mutazionali sul DNA.
Le attuali conoscenze del DNA umano e gli studi di omica (nutrigenomica, transcrittomica, epigenomica, proteomica, metabolomica) hanno permesso di capire che gli alimenti possono modificare il nostro DNA e l’espressione di alcuni geni. Nel caso dei PC del voo possiamo avere due vie di attività secondo la concentrazione, via diretta, se questa è elevata ed è di tipo antiossidante scavenging dei radicali mentre, se è bassa, come nel distretto citoplasmatico e plasmatico, via indiretta. Questa tipo di risposta, dipendente dalla dose, viene definita di tipo ormetica e nel caso dei PC, effetto “ormetico positivo”. Le molecole di PC che hanno ceduto il loro atomo d’idrogeno, per impedire che altre strutture fondamentali fossero danneggiate dai radicali liberi, diventano PC-ossidati (chinonici o semichinonici) capaci di indurre uno stress ossidativo transitorio e debbono essere smaltiti. Conseguentemente possono innescare un segnale di sovraregolazione degli enzimi endogeni antiossidanti che possano portare la cellula a un livello superiore di protezione agli effetti dannosi dello stress ossidativo. I Pc-ossidati, entrati nella cellula, si legano al complesso Keap1-SH--Nrf2--Keap1-SH. Questo legame porta all’ossidazione dei gruppi tiolici (-SH) formando Keap1-SS—SS-Keap1, si libera il fattore di trascrizione Nrf2 che migra nel nucleo, si lega alla sequenza del DNA di 16 basi (5’-T-A/C-A-nn-ATGA-C/T-nnn-GCA-3’ dove n= qualsiasi base) denominata ARE (Antioxidant Response Element) attivando i geni dai quali vengono trascritti RNA-messaggeri e quindi sintetizzati dalla cellula una serie di enzimi antiossidanti e detossificanti di fase II della via ossidoriduttasica in risposta a stimoli nocivi. La risposta è l’aumento dell’attività di enzimi come GPX plasmatica (glutatione perossidasi- degrada perossidi), CAT eritrocitaria (catalasi- degrada perossidi) e GSH plasmatici (glutatione ridotto- forte antiossidante che può ossidarsi a G-S-S-G), e altri enzimi antiossidanti. Non dobbiamo dimenticare che il fattore nucleare Nrf2 è un punto chiave, oltre al mantenimento dell’omeostasi redox cellulare, di azioni detossificanti (metabolismo dei farmaci), metabolismo dell’emoglobina dei globuli rossi, metabolismo dei lipidi e lipogenesi, gluconeogenesi, autofagia e apoptosi (morte cellulare programmata, attività che perdono le cellule tumorali). Gli enzimi antiossidanti endogeni, Nrf2- dipendenti, proteggono anche il DNA dall’attacco di radicali di sostanze chimiche genotossiche, responsabili dell’attivazione di oncogeni o di danni mutazionali sul DNA.
Se la concentrazione di PC è così bassa nel plasma e di breve durata, dopo l’ingestione, con quale meccanismo viene impedita l’ossidazione dei lipidi delle lipoproteine a bassa densità (LDL) come prevenzione dell’aterosclerosi? Potrebbero i PC concentrarsi nello spazio interno delle particelle LDL e agire con un meccanismo antiossidante diretto. Si è anche ipotizzato che alcuni prodotti derivati della vitamina E (componente lipofilo non enzimatico del voo, presente anche nella membrana cellulare, potente antiossidante di tipo “chain-breaking”) possano, dopo la cessione di atomi d’idrogeno, formare molecole tocoferil-chinoniche potenzialmente tossiche e quindi capaci di stimolare la risposta genica come gli analoghi composti chinonici derivati dai polifenoli ossidati appena descritti.
Bibliografia
Piroddi M.et Coll. Nutrigenomic of extra-virgin olive oil: A review. 2016,Wiley Online Library;43,17-41; doi:10.1002/biof.1318
Ma Q. Role of Nrf2 in oxidative stress and toxicity. 2013, Annu. Rev. Pharmacol. Toxicol.,53;401-426; doi:10.1146/annurev-pharmtox-011112-140320
Rodriguez-Morato J. Et Coll. Potential role of olive oil phenolic compounds in the prevention of neurodegenerative diseases. 2015: Molecules; 20, 4655-4680; doi:10.3390/molecules20034655
















Commenta la notizia
Per commentare gli articoli è necessaria la registrazione.
Se ancora non l'hai fatto puoi registrati cliccando qui oppure accedi al tuo account cliccando qui
Commenti 0