L'olio extra vergine di oliva fa bene alla salute? Merito della biodiversità

Una ricerca dell'Agenzia delle Dogane e dell'Istituto di biofisica del Cnr ha messo in luce come la capacità antiossidante dell'olio extra vergine di oliva dipende fortemente dal tipo e dalla composizione di specie chimiche presenti nell’estratto biofenolico e che gli antiossidanti possono proteggere le cellule dallo stress ossidativo tramite meccanismi multipli
Lo stress ossidativo è una delle principali caratteristiche cellulari che porta all'insorgenza di numerose condizioni patologiche, come l’Alzheimer [1], il Parkinson [2], le malattie renali [3], il diabete [4], l'ischemia [5], l’aterosclerosi [6], la disfunzione polmonare. Si verifica a danno delle cellule quando si producono eccessive generazioni di radicali liberi, ossia specie di ossigeno reattivo (ROS) e azoto reattivo (RNS) particolarmente instabili, come conseguenza di un’eccessiva secrezione di enzimi endogeni specifici (superossido dismutasi, catalasi, glutatione reduttasi e glutatione perossidasi) o a seguito di fattori esterni scatenanti quali l’eccessiva esposizione ai raggi UV [7], l’inquinamento atmosferico[8], le radiazioni ionizzanti [9,10] ed il fumo [11].
A causa delle importanti conseguenze dello stress ossidativo sulla salute dell’uomo, numerosi studi scientifici hanno rivolto la loro attenzione alla scoperta e alla valorizzazione di alimenti contenenti sostanze antiossidanti da utilizzare come terapici naturali contro lo stress ossidativo.
 E’ stato dimostrato che rispetto agli altri oli vegetali commestibili, l'Olio ExtraVergine di Oliva presenta eccellenti proprietà salutistiche dovute soprattutto alla presenza di composti antiossidanti attivi quali i biofenoli. Anche se costituiscono solo una piccola quantità della frazione insaponificabile, i biofenoli degli oli hanno evidenziato, negli studi scientifici recentemente condotti, un importante potere salutistico contro patologie come stress ossidativo, infiammazione, malattie cardiovascolari [12], malattie legate all'invecchiamento e in alcuni casi anche contro il cancro [13]. E’ inoltre risaputo che i biofenoli, oltre ad essere composti bioattivi, rappresentano la principale componente chimica che contribuisce alle proprietà sensoriali degli oli da oliva quali l’amaro ed il piccante.
E’ stato dimostrato che rispetto agli altri oli vegetali commestibili, l'Olio ExtraVergine di Oliva presenta eccellenti proprietà salutistiche dovute soprattutto alla presenza di composti antiossidanti attivi quali i biofenoli. Anche se costituiscono solo una piccola quantità della frazione insaponificabile, i biofenoli degli oli hanno evidenziato, negli studi scientifici recentemente condotti, un importante potere salutistico contro patologie come stress ossidativo, infiammazione, malattie cardiovascolari [12], malattie legate all'invecchiamento e in alcuni casi anche contro il cancro [13]. E’ inoltre risaputo che i biofenoli, oltre ad essere composti bioattivi, rappresentano la principale componente chimica che contribuisce alle proprietà sensoriali degli oli da oliva quali l’amaro ed il piccante.
Nel presente lavoro, il contenuto biofenolico di 51 Oli ExtraVergini di Oliva (OEVO), di origine italiana e spagnola, è stato quantificato ed identificato chimicamente per poi testarne le capacità antiossidanti chimicamente attraverso il saggio ORAC ed in vitro su cellule di fibroblasti embrionali di topo.
Sono stati campionati per l’esperimento 32 oli italiani, provenienti dall’areale della provincia di Trapani (Sicilia), e 19 oli spagnoli, tutti prodotti durante la campagna olivicola del 2014. Gli oli italiani erano blend delle cultivar Nocellara del Belice, Biancolilla e Cerasuola; gli oli spagnoli monovarietali di Arbequina e Picual.
Gli estratti biofenolici sono stati preparati secondo la metodica ufficiale del Consiglio Oleico Internazionale (COI): 5ml di una soluzione di metanolo ed acqua (80:20 %) sono stati aggiunti a 2gr di olio e dopo ultrasonicazione e centrifugazione è stata prelevata la frazione idrofobica e conservata a 4°C ed al buio prima delle successive analisi.
Per valutare l’eterogeneità dei campioni considerati, in merito al quantitativo di polifenoli totali, è stato applicato agli estratti biofenolici il saggio colorimetrico di Folin Ciocalteau secondo il metodo di Hrncirik et al. [14].
Per l’identificazione qualitativa e la valutazione quantitativa di ogni singolo componente della frazione polifenolica sono state utilizzate tecniche analitiche quali la Cromatografia Liquida accoppiata alla Spettrometria di Massa (HPLC-MS) secondo il protocollo del COI - "Determinazione dei biofenoli degli oli di oliva mediante HPLC", COI/T.20/Doc.n.29, 2009.
L’analisi HPLC-MS ha permesso di individuare numerosi composti chimici, tra i quali acidi fenolici (caffeico, vanillico, siringico, p-cumarico, o-cumarico, protocatechico, sinapico, p-idrossibenzoico e acidi gallico), alcoli fenolici (tirosolo e idrossisosrosolo), flavonoidi, lignani e secoiridoidi. Più in dettaglio, idrossitirosolo (3,4-diidrossifeniletanolo o 3,4-DHPEA) e tirosolo (p-idrossifeniletanolo o p-HPEA) che sono dei composti abbondantemente ed esclusivamente presenti in olive, foglie di ulivo e olio d'oliva, come composti liberi o legati all'acido elenolico (EA) o alla sua forma dialdeidica (EDA), e che danno origine ai seguenti derivati secoiridoidi: 3,4-DHPEAEA (oleuropeina aglicone), p-HPEA-EA (ligstroside aglicone), 3,4- DHPEA-EDA, oleuropeina e p-HPEA-EDA (oleocanthal) [15]. Quest'ultimo particolarmente responsabile del gusto amaro e piccante del olio d'oliva, con riconosciuta attività antiinfiammatoria simile all'ibuprofene [16].
La capacità antiossidante del contenuto biofenolico totale degli estratti dei 51 campioni di OEVO è stata valutata con saggio ORAC (Oxygen radical absorbance capacity). Tale test, solitamente eseguito per determinare la capacità antiossidante di succhi di frutta, bevande e olio d'oliva, è considerato un buon metodo per valutare quantitativamente la forza antiossidante di un composto chimico o di una miscela di composti [17,18,19].
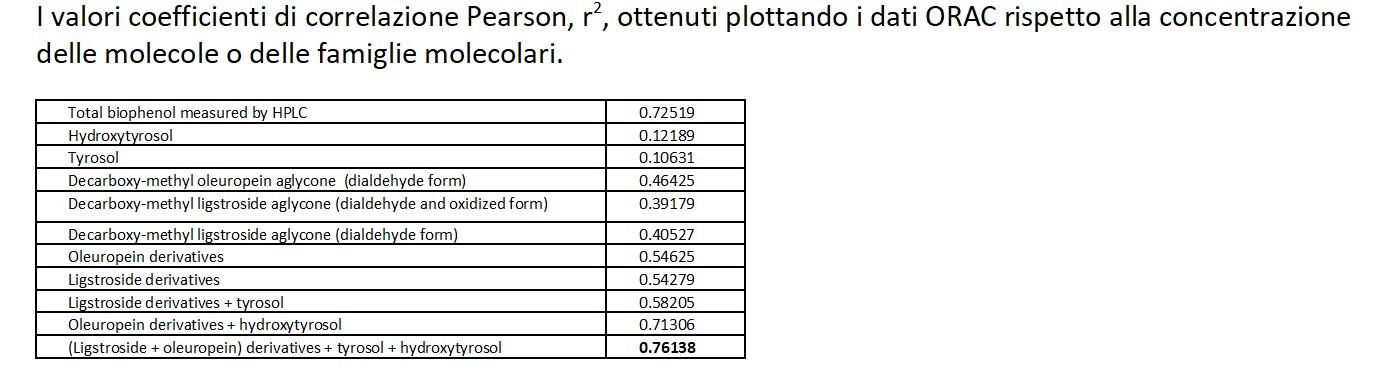
La composizione in biofenoli, il contenuto totale di polifenoli e la capacità antiossidante dei 51 campioni di OEVO sono stati alla base di prove di correlazione tra il dato di ORAC ed i vari biofenoli (coefficiente di correlazione di Pearson - r2), per individuare quale o quali composti esprimono maggiore capacità antiossidante. Come indicato nella tabella sottostante, il più alto coefficiente di correlazione, r2, è stato ottenuto tra il valore ORAC e la concentrazione della famiglia molecolare composta dai derivati di ligstroside ed oleuropeina assieme alla concentrazione di idrossitroso e tirosolo.
I risultati ottenuti dalle valutazioni chimiche e dalle correlazioni matematiche sono stati sperimentati in vivo su cellule di fibroblasti embrionali di topo (NIH-3T3) considerate cellule modello per gli esperimenti di stress cellulare. Solo alcuni degli estratti biofenolici sono stati selezionati per le prove in vitro, come da figura sottostante. Le cellule NIH-3T3 sono state sottoposte a stress ossidativo da ROS utilizzando il TBH (tert-Butyl hydroperoxide solution) secondo il metodo di Wang e Josef [20].
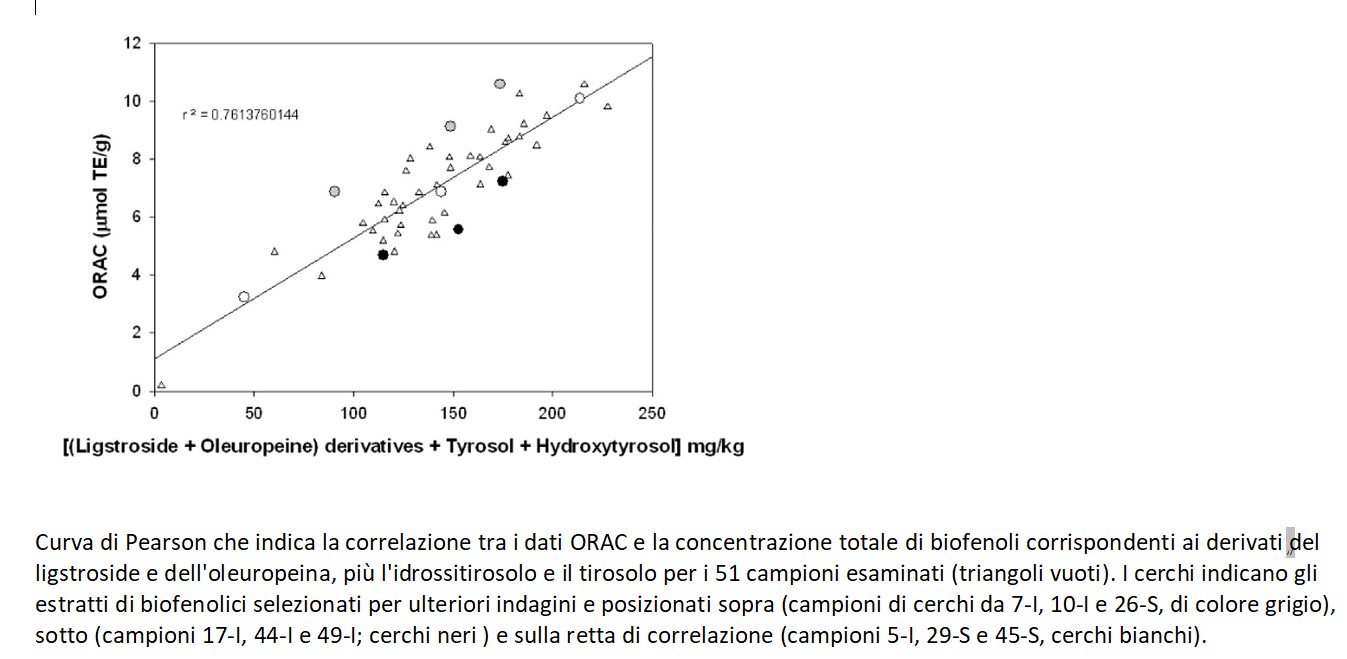
Tutti i 9 estratti biofenolici selezionati, utilizzati sulle cellule alla stessa concentrazione (50 ng/mL), hanno dimostrato potere antiossidante nei confronti del TBH: nello specifico dal 18 (per 10-I) al 41% (per 44-I) di attività.
Sebbene ci sia una buona correlazione tra la capacità antiossidante degli estratti testati e i loro valori ORAC, alcuni campioni sembrano non rispettare questa regola. In particolare il campione 44-I ha mostrato un’ottima capacità nel contrastare lo stress ossidativo da ROS in vitro (44%) pur avendo un basso valore di ORAC (5,6 μmol TE/g) ed un contenuto biofenolico, misurato sia con HPLC (223,0 mg/kg) che F-C (225,3 mg/kg), relativamente alto. Il campione 44-I presenta una peculiarità, ovvero la sua concentrazione in ligstroside aglicone (sia nella forma aldeidica che nella forma idrossilica) è significativamente più alta rispetto agli altri estratti.
Questi risultati suggeriscono che la capacità antiossidante dipende fortemente dal tipo e dalla composizione di specie chimiche presenti nell’estratto biofenolico e che, a causa di elevata complessità dei sistemi biologici, gli antiossidanti possono proteggere le cellule dallo stress ossidativo tramite meccanismi multipli.
Gli autori auspicano di testare l’effetto del ligstroside aglicone nella forme aldeidica ed idrossilica purificato in studi futuri, che potranno ampliare le conoscenze sull’importanza della frazione biofenolica degli oli extravergini d’oliva sulla salute dell’uomo.
Lavoro scientifico pubblicato su Biophysical Chemistry, Volume 230, November 2017, Pages 109-116
Bibliografia
[1] W.J. Huang, X. Zhang, W.W. Chen, Role of oxidative stress in Alzheimer's disease, Biomed. Res. 4 (2016) 519–522.
[2] S.R. Subramaniam, M.F. Chesselet, Mitochondrial dysfunction and oxidative stress in Parkinson's disease, Prog. Neurobiol. 106–107 (2013) 17–32.
[3] A. Modaresi, M. Nafar, Z. Sahraei, Oxidative stress in chronic kidney disease, Iran. J. Kidney Dis. 9 (2015) 165–179.
[4] A.C. Maritim, R.A. Sanders, J.B. Watkins III, Diabetes, oxidative stress and antioxidants:a review, J. Biochem. Mol. Toxicol. 17 (2003) 24–38.
[5] H. Chen, H. Yoshioka, G.S. Kim, J.E. Jung, N. Okami, H. Sakata, C.M. Maier, P. Narasimhan, C.E. Goeders, P.H. Chan, Oxidative stress in ischemic brain damage: mechanisms of cell death and potential molecular targets for neuroprotention, Antioxid. Redox Signal. 14 (2011) 1505–1517.
[6] F. Bonomini, S. Tengattini, A. Fabiano, R. Bianchi, R. Rezzani, Atherosclerosis and oxidative stress, Histol. Histopathol. 23 (2008) 381–390.
[7] S. Karthi, R.Sankari, M.S.Shivakumar, Ultraviolet-B light induced oxidative stress: effects on antioxidant response of Spodoptera litura, J. Photochem. Photobiol. B 135 (2014) 1-6.
[8] M. Ludovici, E. Bigagli, Oxidative stress and air pollution exposure, J. Toxicol. 2011 (2011) 487074.
[9] E.I. Azzam, J.P. Jay-Gerin, D. Pain, Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury, Cancer Lett. 327 (2012) 48–60.
[10] I. Szumiel, Ionizing radiation-induced oxidative stress, epigenetic changes and genomic instability: the pivotal role of mitochondria, Int. J. Radiat. Biol. 91 (2015) 1–12.
[11] J.F. Donohue, Ageing, smoking and oxidative stress, Thorax 61 (2006) 461–462.
[12] M.D. Kontogianni, D.B. Panagiotakos, C. Chrysohoou, C. Pitsavos, A. Zampelas, C. Stefanadis, The impact of olive oil consumption pattern on the risk of acute coronary syndromes: the Cardio 2000 case-control study, Clin. Cardiol. 30 (2007) 125–129.
[13] A. Slomski, Mediterranean diet with olive oil may reduce breast cancer risk, JAMA 314 (2015) 2122.
[14] K. Hrncirik, S. Fritsche, Comparability and reliability of different techniques for the determination of phenolic compounds in virgin olive oil, Eur. J. Lipid Sci. Technol.
106 (2004) 540–549.
[15] R. Fabiani, Anti-cancer properties of olive oil secoridoid phenols: a systematic review on in vivo studies, Food Funct. 7 (2016) 4145–4159.
[16] G.K. Beauchamp, R.S. Keast, D. Morel, J. Lin, J. Pika, Q. Han, C.H. Lee, A.B. Smith, P.A. Breslin, Ibuprofen-like activity in extra-virgin olive oil, Nature 437 (2005) 45–46.
[17] G. Cao, H.M. Alessio, R.G. Cutler, Oxygen-radical absorbance capacity assay for antioxidants, Free Radic. Biol. Med. 14 (1993) 303–311.
[18] P. Ninfali, M. Bacchiocca, E. Biagiotti, M. Servili, G. Montedoro, Validation of the Oxygen Radical Absorbance Capacity (ORAC) parameter as a new index of quality and stability of virgin olive oil, J. Am. Oil Chem. Soc. 79 (2002) 977–982.
[19] H. Wang, G. Cao, R.L. Prior, Total antioxidant capacity of fruits, J. Agric. Food Chem. 44 (1996) 701–705.
[20] H. Wang, J.A. Joseph, Quantifying cellular oxidative stress by dichlorofluoresce in assay using microplate reader, Free Radic. Biol. Med. 27 (1999) 612–616.
















Commenta la notizia
Per commentare gli articoli è necessaria la registrazione.
Se ancora non l'hai fatto puoi registrati cliccando qui oppure accedi al tuo account cliccando qui
Commenti 1
alessandro vujovic
20 novembre 2017 ore 23:47Nel metodo ORAC, studiato con HPLC-MS (High Performance Liquid Chromatography-Mass Spectrometry), la molecola “probe” fluorescente agisce come “radical scavenging” secondo la tipologia HAT (Hydrogen Atom Transfer) ovvero l’inibizione dell’attività ossidante del radicale avviene tramite cessione di un atomo di idrogeno del gruppo ossidrilico (-OH fenolico). La maggior parte degli studiosi sono concordi che il secondo ossidrile fenolico dell’idrossitirosolo (3,4 DHPEA), o dell’isomero dell’oleuropeina aglicone (3,4 DHPEA-EA) o dell’oleaceina (DHPEA-EDA) determina un maggiore potere antiossidante rispetto ai derivati del ligustroside (p-HPEA, p-HPEA-EA, p-HPEA-EDA) in quanto è minore l’entalpia di dissociazione dell’idrogeno dall’ossigeno ossidrilico. Nel gruppo ossidrilico l’idrogeno è legato debolmente con l’ossigeno (più elettronegativo), ovvero gli elettroni di legame (-0--H) passano più tempo sull’ossigeno che sull’idrogeno per cui questi è facilmente cedibile (potere antiossidante) nel contempo l’elettrone spaiato dell’idrogeno, rimasto nell’anello fenolico, va a delocalizzarsi sull’anello stesso senza modifiche strutturali (stabilizzato dalla risonanza). E’ fondamentale che il gruppo ossidrilico, sia dei derivati dell’oleuropeina che del ligustroside, sia facilmente attaccabile dalla specie radicalica, che deve inattivare, per cui non deve subire l’ingombro sterico dei gruppi laterali. Fatta questa premessa cosa possiamo ipotizzare da questa ricerca? Innanzitutto i primi dubbi sono sulla metodologia ORAC perchè i radicali alchilperossilici (ROO°) ottenuti dalla decomposizione termica di un azocomposto organico non sono presenti in natura nelle cellule eucarioti. Allora come spiegare la discrepanza tra un potere antiossidante “in vitro” e un basso valore ORAC del ligustroside aglicone nelle due forme del suo componente (acido elenolico), sia aldeidica che idrossilica? L’azione antiossidante potrebbe non essere primaria (chain breaking) mediante cessione di atomi d’idrogeno o di uno o più elettroni, ma un’azione antiossidante secondaria secondo un meccanismo che ritarda la cinetica del processo di iniziazione radicalica. Ci sono molecole che agiscono sia come ritardanti che come scavenger. Il ligustroside in oggetto, con un basso valore di ORAC, potrebbe agire “in vitro” su alcuni antiossidanti endogeni enzimatici cellulari (Superossido-dismutasi, Catalasi, Glutatione perossidasi) più che avere un’azione antiossidante primaria determinata dalla cessione di atomi d’idrogeno (modalità chain-breaking).